论文总字数:15809字
目 录
1.引言 4
2.材料与方法 4
2. 1 实验材料 4
2. 2实验仪器 4
2. 3 实验方法 5
2. 3. 1开放系统的预平衡实验 5
2. 3. 2方解石对无机磷的固定 5
2. 3. 3比色过程 5
2. 3. 4测定钙含量 5
2. 3. 5数据处理 5
3.结果与讨论 6
3.1预平衡过程 6
3.2方解石对磷的固定作用的研究 7
3.2.1反应平衡时溶液的pH 7
3.2.2反应平衡时溶液中的钙浓度 8
3.2.3方解石除磷过程 9
3.2.4钙磷固相的饱和指数 10
3.2.5 Langmuir 模型非线性拟合 11
4.结论 12
参考文献 12
致谢 15
1.引言
磷是生物生长所必须的营养物质[1],但是随着工业的迅猛发展和人们生活水平的大幅提高,大量的磷随污水被排放到江河湖海中,造成了一系列的环境污染问题,对人们的健康产生了严重威胁[2]。在众多的水环境污染问题中,人们对水体的富营养化问题尤为关注[3-5]。水体富营养化的发生,主要是由于水体中氮、磷等营养元素的增多引起的,从现象上看,富营养化现象的发生与水体中藻类的多寡密切相关。在藻类繁殖所需要的各种成分中,成为限制因素的氮和磷主要来自农业面源污染,农田径流和固体废弃物的淋溶污染等[6]。水体富营养化使藻类异常繁殖和生长,进而堵塞水道,占据水生生物生存空间,引起水臭水味,更会破坏水体中生态系统的原有平衡[7-9]。当前,国内常用的除磷方法分为化学除磷和生物除磷两种。化学除磷法实施成本相对较高,并且容易产生大量的化学污泥[10],进而形成二次污染,其主要工艺有铝盐除磷、铁盐除磷以及石灰混凝除磷;生物除磷法运行成本相对经济,但只有对环境的要求比较高时才可保证出水水质,其处理工艺有厌氧-好氧除磷工艺(A/O生物除磷工艺)、Phostrip除磷工艺。近年来,方解石作为一种新型天然吸附材料被人们广泛研究,它是自然界中最常见的矿物之一,其晶体构造由三方晶系组成,三方菱面体格子转换成的六方双重体心格子,属于复三方偏三角面体晶类[11-12]。在磷去除方面与其他吸附材料相比,方解石的优势在于易于获得,成本低廉,并且对环境没有污染,本研究将探讨方解石对磷酸盐的固定作用随时间的变化规律以及不同磷酸盐浓度对结果的影响。
2.材料与方法
2. 1 实验材料
方解石CaCO3 (分析纯,西陇化工股份有限公司),粒径约3000 nm比表面积约为2.145 m2/g
磷酸二氢钾KH2PO4(分析纯,上海凌峰化学试剂有限公司)
四水合钼酸铵(NH4)6Mo7O24·4H2O(分析纯,合肥科华精细化工研究所)
浓硫酸H2SO4(分析纯,上海凌峰化学试剂有限公司)
抗坏血酸C6H8O6(分析纯,国药集团化学试剂有限公司)
酒石酸锑钾KSbC4H4O7·1/2H2O(化学纯,广东省化学试剂工程技术研究开发中心)
2. 2实验仪器
电子分析天平(上海上天精密仪器有限公司,FA2004)
pH计(安莱立思仪器科技有限公司,PH400)
恒温振荡器(太仓市强乐实验设备有限公司,THZ-C)
全温振荡培养箱(太仓市强乐实验设备有限公司,HZL-F100)
电热恒温鼓风干燥箱(上海跃进医疗器械有限公司,HENGZI)
双向恒温磁力搅拌器(上海司乐仪器有限公司,85-2)
752紫外可见分光光度计(上海菁华科技仪器有限公司,CARY-50)
原子吸收分光光度计(安捷伦上海分析仪器公司,3150 G,Ca检测限为0.5 mg/L) 真空抽滤装置(包括0.45 µm滤膜)等。
2. 3 实验方法
2. 3. 1开放系统的预平衡实验
称4 g方解石粉末到100 mL 三角瓶,加80 mL 蒸馏水,测pH,盖上保鲜膜,扎孔,置于恒温振荡箱振荡(温度25℃,转速170 r/min)。按1、2、5、8、12、24 h时间点测pH,并记录数据,若24 h后测得pH在8.3左右时,说明预平衡已完成,若不是,则继续振荡直到达到8.3左右为止。
2. 3. 2方解石对无机磷的固定
制取平衡液:选取一个2 L的干净烧杯,称取20 g碳酸钙和2 L的蒸馏水加到烧杯中,然后用泵通入空气,使其持续不断地搅拌溶液。在此过程中,分别在0、1、2、5、8、12、24、36、48 h时测定烧杯内溶液的pH并记录。3天后,用真空抽滤装置对烧杯内溶液进行抽滤,得到澄清的碳酸钙平衡液。
配置系列磷溶液:称取0.900 g KH2PO4 到100 mL 容量瓶,得2.05 g/L的磷溶液,即2050 mg/L;通过稀释的方法得到4.1、20.5、61.5、205、410、1025 mg/L的磷溶液,分别从上述系列磷溶液中吸取2 mL 到80 mL 碳酸钙平衡液中,得到0.1、0.5、1.5、5 、10、25 mg/L(即0、3.2、16.1、48.4、161、322.6、806.5 µmol/L)目标溶液。
恒温振荡培养实验:预平衡完成后测目标溶液pH并补水,在每个碳酸钙平衡液中加2 mL 已配置的系列磷溶液,盖上保鲜膜,扎孔,放入恒温振荡培养箱振荡培养,按0.5、1、2、5、8、12、24 h时间点,按顺序取2个重复,测pH并记录,然后用真空抽滤装置抽取30 mL 滤液并保存。
2. 3. 3比色过程
加入钼锑抗显色后,使用752紫外可见分光光度计(调880 nm波段,可见光)进行比色,测定磷酸盐浓度。
2. 3. 4测定钙含量
对保存好的抽滤液用浓盐酸进行酸化,然后将其稀释10倍后,通过原子分光光度计进行测定溶液中钙的浓度。
2. 3. 5数据处理
计算方解石对磷酸盐的去除量 qe(µmol/m2),采用公式:
qe = (c0-ce )×V/m
其中,c0 和ce 分别代表反应前、后溶液中的磷的浓度(µmol/L);qe 表示反应平衡时的磷酸盐的去除量(µmol/m2);V 指溶液体积(L);m 指方解石的质量(g);方解石比表面积约为2.145 m2/g。
3.结果与讨论
3.1预平衡过程
据研究报道[13-16],水体中存在着CO2、CO32-、HCO3-和H2CO3等四种化合态,常把CO2和H2CO3合并为H2CO3*,而实际上水体中的H2CO3含量极低,主要是溶解性气体CO2。因此,水体中的CO32--HCO3--H2CO3*体系可用下面的反应和平衡常数来表示:
CO2 H2O↔H2CO3* pK0=1.46 (1)
H2CO3*↔H HCO3- pK1=6.35 (2)
HCO3-↔H CO32- pK2=10.33 (3)
碳酸钙溶解可用以下反应来表示:
CaCO3 (s)↔CaCO3 (aq) K1= 10−5.09 (4)
CaCO3( aq)↔Ca2 CO32- K2= 10−3.25 (5)
CO32- H2O↔HCO3- OH- K3= 10−3.67 (6)
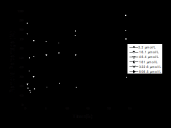
图1表示的是开放体系下碳酸钙溶液的预平衡过程,溶液pH 随时间变化的结果,图中显示,在0时刻时pH值很高(在10左右),随后逐渐下降,24 h 后趋向稳定,大概在8.3左右溶液达到平衡状态。这是因为开始阶段方解石溶解时(见反应(4)~(6)),大量的CO32-释放到溶液中,而空气中CO2不能迅速溶解到溶液中,从而使该体系pH值很高,随着不断的进行振荡培养,空气中CO2不断溶解进来(见反应(1)~(3)),使得溶液pH值不断下降,最后当体系达到平衡时,溶液的pH就不再发生变化了。经计算得到,开放体系下碳酸钙溶液的预平衡完成时的pH值接近8.3,该理论值与本实验得到的实验结果相一致。所以,本实验的全部样品的预平衡处理均采用恒温振荡培养24 h的方法,使碳酸钙溶液体系达到平衡状态。

图1碳酸钙溶液预平衡过程中pH随时间的变化
3.2方解石对磷的固定作用的研究
3.2.1反应平衡时溶液的pH
表1反映出在不同磷酸盐浓度下,溶液的pH一开始均有下降的趋势,随着反应的进行,溶液的pH又渐渐恢复过来,基本与预平衡后的pH相同,这种变化的幅度随着加入的磷酸盐浓度增加而变大,这可能是因为加入的磷酸盐的浓度还比较低,对体系酸碱度的影响很小;所以当磷酸盐浓度为322.6、806.5 µmol/L时,其对体系酸碱度的影响较大,使得溶液pH变化幅度较大,不过当反应完成时,体系pH又基本恢复到8.3左右。从表中不难看出,整个反应过程溶液pH均在7.5~8.5,而在这种pH下,根据图2的磷酸分布曲线得出加入的无机磷酸盐是以HPO42-的形式存在于溶液中的,所以溶液中主要存在的是HPO42-、Ca2 和CO32-,发生的固定作用可以通过以下反应来描述[17-19]:
Ca2 HPO42- = CaHPO4 pK = −7.0 (7)
剩余内容已隐藏,请支付后下载全文,论文总字数:15809字
相关图片展示: