论文总字数:18747字
摘 要
目的:探究CD133 胶质瘤细胞的放射生物学特性,研究自噬调节剂氯喹、雷帕霉素对U251人脑胶质瘤细胞的放射敏感性的影响,并为深入研究自噬对肿瘤细胞及肿瘤干细胞的影响奠定基础。方法:采用免疫磁珠分选法分选出CD133 胶质瘤细胞,然后以CCK-8试剂盒为实验试剂,通过连续四天测定CD133 、CD133-细胞及未分选细胞的OD值来作出它们各自的生长曲线,验证分选出的CD133 细胞的生长活性;然后通过克隆形成试验及放射敏感性实验,并得到出3种细胞在不同放射剂量下的克隆形成数,再利用SPSS19.0以及单击多靶模型和线性二次模型拟合分析得到三种细胞的放射剂量和生存分数拟合曲线以及其他放射生物学参数,初步判断3种细胞的放射生物学特性;另通过加药组(氯喹和雷帕霉素)的克隆形成实验,得到加药组CD133 细胞的存活率变化趋势图,初步判断自噬调节剂对细胞放射敏感性的影响;最后通过流式细胞仪来测定细胞的凋亡情况。结果:CD133 细胞的生长速度最快,未分选次之,CD133-细胞最慢;CD133 放射敏感性最弱,未分选次之,CD133-最强;氯喹可减弱CD133 的放射敏感性,雷帕霉素可增强CD133 的放射敏感性。
Abstract
Objective: To explore the biological characteristics of CD133 glioma cells in radiation, radiosensitivity of autophagy regulator chloroquine and rapamycin on U251 human glioma cells ,and for further study of autophagic foundation on tumor cells and tumor stem cells to establish base. Methods: MACS sorting sorted CD133 glioma cells, then in four day, CCK-8 kit as laboratory reagents, to mearsure OD of CD133 , CD133- cells and unsorted cells to make their growth curve; then clone formation assay of 3 kind of cell, and use SPSS19.0 and use nolinear to anaiyse the arguments of radiobiology and make the fitted curve;then to do clone formation assay about chloroquine and rapamycin in CD133 cell to find survival trends change, initially make a judgement about autophagy modulators’ function in cellular radiosensitivity; and finally apoptotic cells was detected by flow cytometry situation. Results: CD133 cells, the fastest growth rate, unsorted followed, CD133- cell slowest; CD133 radiosensitivity weakest unsorted followed, CD133- strongest; chloroquine can be reduced radiosensitivity of CD133 , Ray rapamycin can enhance the radiosensitivity of CD133 .
关键词:U251,CD133 细胞,自噬,放射敏感性
目录
中文摘要 1
Abstract 2
第一章 绪论 4
1.1 肿瘤干细胞理论 4
1.2 肿瘤干细胞特征 5
1.3 肿瘤干细胞的分选 5
1.4 自噬与肿瘤细胞的放射敏感性 6
1.4.1 自噬定义及意义 6
1.4.2 自噬发生的过程 6
1.4.3 自噬的调控途径 7
1.4.4 自噬与肿瘤 8
1.4.5自噬与放射敏感性 8
第二章 实验材料与方法 10
2.1 实验材料及试剂 10
2.1.1 实验材料、试剂及使用的主要仪器 10
2.1.2 主要试剂配置 11
2.2 实验方法 12
2.2.1 实验流程 12
2.2.2 实验方法 13
第三章 结果与讨论 18
3.1 实验结果 18
3.1.1 免疫磁珠分选法分选细胞结果 18
3.1.2 三种细胞生长曲线结果 18
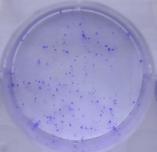
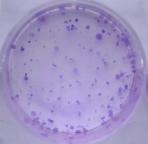
3.1.3 细胞克隆形成实验结果 18
3.1.4 流式细胞仪检测凋亡结果 23
3.2 结果讨论 24
参考文献 25
致谢 27
- 绪论
1.1 肿瘤干细胞理论
在人体颅内肿瘤中,胶质瘤病发比例占到了半数以上;另一方面,就人体全身恶性肿瘤死亡率来看,胶质瘤因其侵润性生长的特性而难以切除,从而导致胶质瘤的术后易复发,最终使得胶质瘤患者因局部侵袭或复发死亡。即便在现有医疗体系对肿瘤的治疗已形成了手术切除、化疗和放疗的综合治疗体系,各类型恶性肿瘤的复发和转移仍然是不可避免的医疗难题。
目前主流的肿瘤治疗是通过手术切除、化疗和放疗对所定位的整个实体肿瘤块进行杀伤,这其实是基于现有传统肿瘤学理论。传统的肿瘤学理论认为,所有的肿瘤细胞都具备自我更新、无限增殖的特性。在肿瘤发生方面,普遍认为是细胞基因突变累积引起原癌基因激活、抑癌基因沉默或抑制,凋亡相关基因表达失常,最终导致细胞生长增殖凋亡异常,从而导致肿瘤发生,传统肿瘤学理论还认为这种突变累积发生于所有的细胞中,任何细胞发展成为肿瘤细胞的概率是一样的。然而传统肿瘤学理论却无法有力地解释经过手术及放化疗的综合治疗后肿瘤的复发及转移,以及复发后肿瘤对放疗化疗的耐受性增强相反地,新的肿瘤学理论即肿瘤干细胞理论为相关问题提供了更加可信可行的理论支撑。
肿瘤干细胞理论认为,在肿瘤组织中,只有很小一部分细胞具有只我更新、分化增殖能力,它们才是引起肿瘤发生,维持肿瘤生长以及保持肿瘤异质性的根源。基于该理论,肿瘤组织是由肿瘤干细胞及其分化而来的各分化程度的异质性细胞组成,肿瘤组织的主体为经分化的异质性细胞。这就好解释传统肿瘤理论不能有力说明的问题了。由于现有的手术切除、放疗和化疗都是针对肿瘤主体即丧失了分化能力的异质性细胞的,并没有针对肿瘤干细胞,那么就有很大的可能性使得对放疗化疗有更强耐受性的肿瘤干细胞在治疗过后存活下来,最终导致肿瘤的复发转移以及复发后的肿瘤组织对放疗化疗更具耐受性。
肿瘤干细胞的发现可以追溯到20世纪50年代,Hewitt等在同种小鼠体内接种白血病小鼠的肿瘤细胞后,发现仅有1%的细胞形成克隆集落[1]。虽然当时并没有肿瘤干细胞的概念,不过这却是肿瘤干细胞理论假说形成的基础。从这我们也能看出,肿瘤干细胞在整个肿瘤组织细胞中所占比例是很小的,然而这并不影响它成为肿瘤形成、发展的动力
1.2 肿瘤干细胞特征
与正常干细胞相比,肿瘤干细胞也具有自我更新、无限增殖的能力,同样的,肿瘤干细胞也不处于分化末端,它依然具备分化潜能这一标志性特征[2]。据了解,肿瘤干细胞与正常干细胞具有类似的分裂方式:对称分裂和不对称分裂。肿瘤干细胞通过对称分裂方式分裂成两个相同的具有分裂分化能力的肿瘤干细胞或者两个相同的处于分化末端的肿瘤细胞,通过不对称分裂分化出一个异质性丧失分化能力的肿瘤细胞和一个仍然具备分化潜能的肿瘤干细胞[3],肿瘤干细胞就是这样来保持自己在肿瘤组织中的一定数量,同时又能产生出许多丧失分化能力的异质性肿瘤细胞的。在1992年,Reynolds等首次分离出神经干细胞(neural stem cells,NSC),最早证实了NSC具有自我更新能力、分化潜能及通过不对称分裂产生异质性后代[4]。
2004年,Singh等采用了类似神经干细胞的培养方法得到了与神经干细胞类似的胶质瘤细胞球,经过观察和进一步的稀释培养,发现里面存在着一小部分细胞起着类似干细胞作用,维持着胶质瘤的发生发展,并且在这些细胞里,通过免疫荧光染色发现绝大部分都高表达CD133这种蛋白,他还利用CD133作为标记物在人脑肿瘤组织中免疫磁珠分选法分离纯化出肿瘤干细胞,CD133 细胞具有很强的增殖分化能力,能在健康的同种小鼠体内能发展成为新的肿瘤组织[5]。他为肿瘤干细胞的存在提供了依据,同时也为肿瘤干细胞的分离鉴定提供了表面标记参考。其他的肿瘤干细胞表面标记还有CD34、CD44、CD166等[6、7],在胶质瘤干细胞研究中,常用CD133作为其标志物。CD133是一种表面粘附分子,它具有一个特性:随着细胞分化程度的加剧,细胞表面CD133分子逐渐减少或消失。这也提示我们肿瘤干细胞可能来源于正常干细胞。
1.3 肿瘤干细胞的分选
目前,分离肿瘤干细胞的分选方法主要有流式细胞技术和免疫磁珠分选法。Singh运用免疫磁珠分选法分选CD133 人脑瘤干细胞,他利用CD133 作为免疫磁珠标记,筛选出CD133 细胞和CD133-细胞,然后通过流式细胞仪检测[5]。另外在国内,王彬等也应用免疫磁珠分选法以CD133作为标志物从在体外培养的已连续传代多次的恶性胶质瘤细胞株U251中成功分离出CD33 肿瘤干细胞,这些细胞在无血清培养液中呈悬浮生长,形成细胞球,具有很强的繁殖分裂能力,免疫荧光染色显示该细胞表达CD133。并且,他们的研究还发现从恶性胶质瘤细胞株U251中培养分离得到的脑肿瘤干细胞和从人恶性胶质瘤组织中分离得到的脑肿瘤干细胞具有及其相似的生物学特性[8]。
1.4 自噬与肿瘤细胞的放射敏感性
如上文所述,肿瘤干细胞对放疗具有更强的耐受性,这也是限制放疗治疗效果的因素。那么如果可以提高肿瘤细胞及肿瘤干细胞的放射敏感性,那么就有可能极大的改善放疗的治疗效果,也能够在相同的治疗效果的前提下,减小放疗用剂量,从而减小对身体正常细胞的损害。而据研究,自噬在对胶质瘤细胞的放射敏感性的增敏作用方面扮演着重要角色[9]。
1.4.1 自噬定义及意义
自噬是真核生物中进化保守的对细胞内物质进行周转的重要过程,是细胞自我消化其胞质内含物的过程,是细胞在饥饿或压力条件下回收能量和养分的临界自适应响应。简单地来说就是胞内一些受损的蛋白或细胞器被双层膜结构的自噬小泡包裹后,送入溶酶体或液泡中进行降解并得以循环利用。自噬在正常的细胞中的发生是低水平持续不断的,它对维持细胞内环境的稳态具有重要意义,正常调控下的自噬过程能有序地清理胞内代谢废物、生物大分子及衰老细胞器,能够促进胞内物质的更新及物质的循环利用。
1.4.2 自噬发生的过程
自噬一般分为4个阶段:自噬前体形成、自噬前体延伸闭合形成自噬体、自噬体可能还要与其他内体吞噬泡融合、自噬体与溶酶体(或液泡)融合形成自噬溶酶体。在自噬前体形成之前,由于各种环境压力或内在应激的作用,引起mTOR活性下降,使得Ulk复合物开始形成并积累。自噬前体的形成由Ulk1/2-Atg13-FIP200复合物调控,并由活化了的III类磷脂酰肌醇3激酶(Vps34)促进。而Vps34是Beclin-1复合物中的一部分,因此能与Beclin-1结合起抑制作用的BCL-2、Bcl-xL等能够在自噬起始抑制自噬,而紫外辐射相关基因可通过增强Beclin-1活性来促进自噬。自噬前体延伸闭合形成自噬体这一过程是由两个泛素化蛋白缀合系统介导的,一个是Atg12-Atg5结合系统,另一个是Atg8酯化系统。在Atg12-Atg5结合系统介导过程中,Atg12首先由类E1泛素活化酶Atg7活化,之后Atg12被传递给类E2泛素活化酶Atg10上被进一步活化,最后Atg12被传递到Atg5上,与Atg5共价结合形成Atg12-Atg5复合物,最终与Atg16L蛋白结合形成Atg12-Atg5-Atg6L化合物,Atg16L起介导该复合物定位于自噬体膜并在自噬体膜闭合时介导该复合物从膜上的分离。Atg8酯化系统包括Atg3、Atg4、Atg7和Atg8(哺乳动物中的同源物为LC-3)。当细胞合成了LC3前体后,LC3的C端被Atg4B切割形成LC3-I,LC3-I在类E1泛素活化酶Atg7和类E2泛素活化酶Atg3的作用下结合PE形成LC3-II,从而介导隔离膜的延伸和闭合,形成自噬泡。自噬泡最终带着内含物与溶酶体结合,并将内含物释放到溶酶体内,内含物在溶酶体被分解达到能量再利用的目的[10]。
1.4.3 自噬的调控途径
自噬在正常生理和病理状态下都会发生,它是维持稳态的一种手段。自噬的调控涉及许多分子,如上文提到的Atgs包括Atg5、Atg7、Atg10等、mTOR、LC3(Atg8)、Beclin-1及Ulk等等,这其中许多都可能能作为检测细胞发生自噬与否以及自噬活性的指标。自噬调控像许多其他生理调控一样并非是由单一信号通路控制的,就现阶段的研究而言,自噬调控涉及的信号通路就有PI3K-Akt-mTOR通路、AMPK通路、NF-κB通路、MAPK通路以及p53通路等[10]。自噬调节途径的多样化,可能也是自噬的调控研究结果存在较大争议的原因之一。
1.4.3.1 PI3K-Akt-mTOR通路
这是最经典的自噬调控通路。经典的PI3K-Akt-mTOR通路主要是通过激活mTOR来调节自噬的。简单地来说,磷脂酰肌醇激酶PI3K通过磷酸化激活蛋白激酶B(Akt),Akt进而作用于其底物PRAS40使其活化,然后PRAS40激活mTOR,Akt还能通过使TSC的失活来激活其下游Rheb,从而激活mTOR。活化了的mTOR对自噬是起抑制作用的,一方面它能抑制Ulk1的活性,从而抑制Ulk复合物的形成,另一方面它能抑制Atg复合物的形成。当细胞处于营养不良的条件下时,mTOR将会失活,进而促进自噬的发生[10]。因此对PI3K-Akt-mTOR通路进行调节可以达到对细胞自噬的调节目的,自噬调节剂雷帕霉素就是以mTOR为靶点对mTOR的活性进行抑制,从而达到增强自噬活性的目的的。
1.4.3.2 AMPK途径
当细胞处于营养能量缺失的状况时,细胞产生相应代谢应激,细胞内AMP/ATP比率及Ca离子浓度上升会激活LKB1蛋白激酶、TAK1和CAMKKβ,磷酸化AMPK使其激活,AMPK作用于TSC2使其磷酸化,从而抑制mTOR的活性,增强自噬活性,活化的AMPK还能直接作用于mTOR使其失活来激活自噬[10]。
1.4.3.3 MAPK通路
MAPK是丝裂原活化蛋白激酶,能被细胞因子、神经递质、激素、细胞应激等激活的丝氨酸-苏氨酸蛋白激酶。它包括ERK及JNK等。细胞饥饿条件下会逐步激活JNK,JNK会通过磷酸化Bcl-2,使得Bcl-2和Beclin-1解偶联,Beclin-1具有增强自噬活性的作用,从而诱导自噬。ERK1/2在Raf-MEK-ERK途径中起促进作用诱导自噬。胞内Ras-GTP信号磷酸化Raf1,活化的Raf1激活MEK,MEK进一步激活ERK1/2,从而诱导自噬[10]。
1.4.3.4 p53通路
转录因子p53是一种肿瘤抑制因子,它在自噬中起的作用看起来是矛盾的。这取决于p53在细胞内处于的亚细胞结构。当p53处于细胞核内时,它对于自噬的作用是积极的,它能通过激活SESTRIN1/2来激活AMPK的活性,进而通过AMPK途径来诱导自噬。然而当p53在细胞核外时,却对AMPK有抑制作用,从而对自噬有抑制作用[10]。
1.4.4 自噬与肿瘤
自噬在肿瘤中具体发挥什么样的作用是跟许多因素有关的,这些影响因素包括染色体损伤、氧化应激、代谢应激等等[10]。自噬在正常调控下能维持细胞内环境的稳态,如细胞内活性氧(ROS)堆积过多会对细胞产生毒性作用,此时过度积累的ROS将会激活细胞发生自噬反应来降低ROS水平或清除已被损伤的细胞器来维持细胞稳态[11]。也就是说自噬能提高细胞的健康程度,故在肿瘤发生之前,认为自噬是对肿瘤发生有抑制作用的。自噬在肿瘤的发生发展中可能起着双重作用,一方面认为自噬在肿瘤细胞受到低氧,电离辐射等的影响引起损伤时起保护作用。另一方面认为自噬可启动肿瘤细胞的细胞自噬性死亡,对肿瘤的生长起到抑制作用 [10]。这也涉及到细胞自噬在肿瘤治疗中的角色,即是作为治疗阻力存在还是作为治疗的助力存在,这一方面是存在争议的。实体肿瘤微环境的共同特点就是存在着巨大的代谢压力,由于血供不足所造成的营养,生长因子,氧供不足等。肿瘤细胞能够在这样艰难的环境中生存并保持其活性,依靠的就是自噬作用。同样地,在治疗肿瘤的过程中,肿瘤细胞通过自噬来抵抗治疗过程中各种理化性质对自身的杀伤作用。但是,许多自噬相关的因子却对肿瘤具有抑制作用。自噬活化基因Beclin-1基因最初是以肿瘤抑制基因报道出来的,且在卵巢癌中被删除达75%,在乳腺癌中被删除达50%-75%[12]。Atg7条件性敲除小鼠的肝脏逐渐出现肝肿大,这可能会恶性转化成恶性肿瘤,它们的肝脏积累异常线粒体以及聚泛素化蛋白质聚集体[13]。最近的一份报告显示,在Atg2B,Atg5的,Atg9B和Atg12上的移码突变与胃癌和结肠癌有关[14],总体而言,有强有力的证据表明Atg蛋白有抑制肿瘤的特点,相关自噬的基因减少可能导致肿瘤的发生。
1.4.5自噬与放射敏感性
有研究表明,通过加药抑制DNA依赖性蛋白质激酶的活性可以激活胶质瘤细胞的自噬活性,进而提高胶质瘤细胞的放射敏感性。在同等剂量的电离辐射照射下,加入了DNA依赖性蛋白质激酶抑制剂的细胞的存活率明显下降,并且DNA依赖性蛋白质激酶缺陷的细胞M059J在经过低剂量的电离辐射的照射后,与正常的M059K细胞相比,发生了细胞自噬性死亡,存活率也大大下降[15]。Fujiwara K等研究发现,U87胶质瘤细胞在Akt抑制剂的作用下,Akt的活性下降,并且经电离辐射照射后细胞的存活率下降,进一步的研究发现,Akt抑制剂诱导了U87细胞发生自噬,从而提高了U87胶质瘤细胞的放射敏感性[16]。
无论如何,还有报道显示,自噬活性的抑制并没有减小肿瘤细胞对电离辐射的放射敏感性,反而是增强了肿瘤细胞的放射敏感性。Yuan X等的实验显示STAT3对U251胶质瘤细胞具有抑制其自噬活性的作用,但同时发现STAT3在抑制U251细胞的自噬活性时,却增强了U251对电离辐射的敏感性 [17] 。这与上文看起来是矛盾了,这也是自噬对肿瘤细胞放射敏感性作用的争议所在。
剩余内容已隐藏,请支付后下载全文,论文总字数:18747字
相关图片展示: