论文总字数:27792字
摘 要
本文从课题的研究背景及意义入手,主要介绍了HDAC/BET双重抑制剂的设计思路,目标化合物中间体的合成过程及表征。
赖氨酸乙酰化作用是调控染色质结构的一个关键机制。异常的赖氨酸乙酰化水平可导致基因表达的改变,从而致使一些疾病的发生,例如肿瘤抑制基因的失活和细胞促分裂基因的激活引起肿瘤。组蛋白赖氨酸的乙酰化程度,主要由组蛋白乙酰化转移酶(HATs)和组蛋白乙酰化消去酶(HDACs)这两种酶共同调节。HDACs是已经得到广泛研究的靶标,尤其是在肿瘤领域。众多高效高选择性HDACs抑制剂的发现促进了人们对于HDACs的分子调节机理的认识,及其在相关疾病治疗中的应用研究。目前肿瘤新药的研发主要集中在HDAC抑制剂。溴结构域是在多种不同蛋白质上发现的一些小的作用单元,可以选择性地识别ε-N-乙酰赖氨酸残基,所以它在乙酰化水平的调节上同样起到至关重要的作用。近年来BET(溴和其他末端结构域蛋白)特异性抑制剂的发现激发了不同治疗领域的深入研究,特别是在抗肿瘤方面。肿瘤的发生常常涉及多个抑癌基因的失活,针对单一基因的治疗不足以抑制肿瘤生长。HDAC/BET双重抑制剂提供了一个新颖的新药研发思路,对实体肿瘤的抑制有可能取得实质性进展。
关键词:肿瘤,赖氨酸乙酰化,溴结构域,去乙酰化酶
Design and synthesis of HDAC/BET dual inhibitors
Abstract
From the background and significance of the research, this paper mainly introduces the design method of HDAC/BET double inhibitors, and the synthesis of target compounds intermediates and their characterization.
The acetylation of lysine is a key mechanism of the structure of chromatin structure. In many diseases, aberrant lysine acetylation leads to changes in gene expression resulting for instance in the inactivation of tumor suppressor genes and the activation of pro-survival and proliferation promoting pathways in cancer. The acetylation level of histone lysine was controlled by histone acetylation (HATs) and histone acetylation (HDACs). HDACs is the target that has been widely studied, especially in the tumor field. The discovery of many highly effective and selective HDACs inhibitors promotes the recognition of the molecular mechanism of HDACs and its application in related diseases. Current research and development of new tumor drugs mainly focused on HDAC inhibitors. The occurrence of tumor often involves the inactivation of multiple tumor suppressor genes. The treatment of single gene is not enough to inhibit tumor growth. HDAC/BET dual inhibitors provide a novel new drug for research and development, and it may make substantial progress in tumor suppression.
KEY WORDS: Tumor, Lysine acetylation of lysine, bromodomain, histone deacetylases
目 录
摘 要 I
Abstract II
第一章 绪论 1
1.1引言 1
1.2研究背景 1
1.2.1赖氨酸乙酰化作用 1
1.2.2溴结构域蛋白简介 3
1.3溴结构域抑制剂的发现与研究进展 4
1.5课题难点 11
1.6 HDAC/BET双重抑制剂的设计与合成路线 11
1.7课题意义 12
第二章 实验部分 13
2.1主要仪器与试剂 13
2.1.1主要仪器 13
2.1.2主要试剂 13
2.2溴结构域抑制剂(±)-JQ1的合成 14
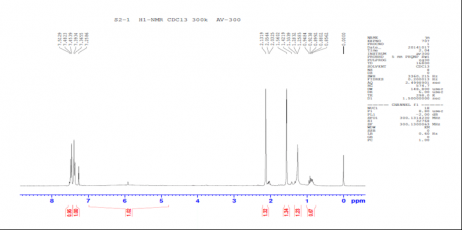
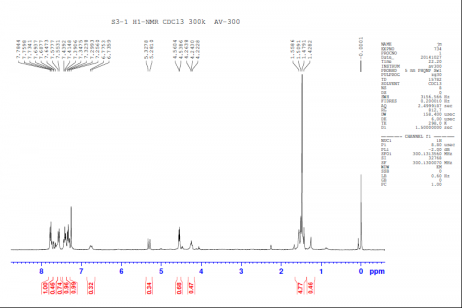
2.2.1中间体S2的合成 14
2.2.2中间体S3的合成 15
2.2.3中间体S4的合成 15
2.2.4中间体S5的合成 15
2.2.5中间体S6的合成 16
2.2.6溴结构域(±)-JQ1的合成 16
第三章 结论 17
致 谢 18
参考文献(References) 19
附 录 21
绪论
1.1引言
肿瘤是仅此于心脑血管疾病的人类健康的第二大杀手。肿瘤的防治,一直是困扰全世界多年的大难题。因此,对于肿瘤治疗的研究,成为了当代医学领域最活跃的课题。药物治疗在对肿瘤,特别是恶性肿瘤的治疗中占有相当重要的地位。可以说,人类在抗肿瘤药物的研究上,已经取得了比较大的进展。
赖氨酸乙酰化作用是调控染色质结构的一个关键机制。异常的赖氨酸乙酰化水平可导致基因表达的改变,从而致使一些疾病的发生,例如肿瘤抑制基因的失活和细胞促分裂基因的激活引起肿瘤。组蛋白赖氨酸的乙酰化程度,主要由组蛋白乙酰化转移酶(HATs)和组蛋白乙酰化消去酶(HDACs)这两种酶共同调节。HDACs是已经得到广泛研究的靶标,尤其是在肿瘤领域。众多高效高选择性HDACs抑制剂的发现促进了人们对于HDACs的分子调节机理的认识,及其在相关疾病治疗中的应用研究。目前肿瘤新药的研发主要集中在HDAC抑制剂。溴结构域(Bromodomains,简称BRDS)是在多种不同蛋白质上发现的一些小的作用单元,可以选择性地识别ε-N-乙酰赖氨酸残基,所以它在乙酰化水平的调节上同样起到至关重要的作用。近年来BET(溴和其他末端结构域蛋白)特异性抑制剂的发现激发了不同治疗领域的深入研究,特别是在抗肿瘤方面。
众所周知,肿瘤的发生常常涉及多个抑癌基因的失活,针对单一基因的治疗不足以抑制肿瘤生长。HDAC/BET双重抑制剂提供了一个新颖的新药研发思路,对实体肿瘤的抑制有可能取得实质性进展。为恢复多个抑癌基因的表达,提高基因组稳定性,通过理解HDAC抑制剂与BET抑制剂的构效关系,设计出具有双重HDAC/BET抑制效果的目标化合物,希望此类目标化合物对癌细胞具有更强的抑制效果。本文将详细介绍关于HDAC/BET双重抑制剂的设计与合成的进展和成果。
1.2研究背景
1.2.1赖氨酸乙酰化作用
早在三十多年前,组蛋白末端赖氨酸残基的ε-N乙酰化就被发现,并且已经和染色质结构、转录激活联系在一起。近期,许多组蛋白乙酰化修饰已经跟染色质紧密,DNA修复,蛋白质稳定性,蛋白质-蛋白质相互作用的调节有关。赖氨酸乙酰化已经作为所谓的组蛋白编码的主要部分用来研究,组蛋白编码是组蛋白翻译后修饰的全部。赖氨酸乙酰化也作为一个在整个蛋白质组发现的、分布广泛的翻译后修饰出现。
蛋白质的赖氨酸乙酰化是染色质中组蛋白修饰的一种,组蛋白存在于核小体中,通过“书写器”和“擦除器”进行翻译后修饰,“书写器”和“擦除器”是一些保留和移除不同化学修饰的酶,化学修饰被效应因子“识别”单元解读,“识别”单元在染色质重组和转录控制环境下翻译它们。书写酶包括组蛋白乙酰转移酶(histone acetyltmnsferse ,HATs),组蛋白甲基转移酶(HMTs)以及激酶。擦除酶包括组蛋白去乙酰化酶(histone deacetylase,HDACs),脱甲基酶(DMTs)以及磷酸酶。可以识别蛋白质的包括一些单元,例如溴结构域,染色质域,植物同源域蛋白,TD结构域,PWWP结构域,恶性脑瘤结构域(MBTs),14-3-3蛋白质和BRCT结构域。化学修饰包括赖氨酸的乙酰化和甲基化,以及丝氨酸,苏氨酸,酪氨酸的磷酸化作用。例如,乙酰化修饰由组蛋白乙酰转移酶(HATs)在赖氨酸残基上存储,溴结构域单元识别,组蛋白去乙酰化酶(HDACs)移除。赖氨酸乙酰化是在乙酰基转移酶(HATs)的作用下,在蛋白质赖氨酸残基上添加乙酰基的过程,是细胞控制基因表达,蛋白质活性或生理过程的一种机制。组蛋白乙酰化大多发生在核心组蛋白N一端碱性氨基酸集中区的特定赖氨酸残基,将乙酰辅酶A的乙酰基转移到赖氨酸的sNH3 中和掉1个正电荷。赖氨酸乙酰化是一个可逆过程,受赖氨酸乙酰基转移酶和去乙酰化酶的共同调节。因此,组蛋白乙酰化水平是由组蛋白乙酰基转移酶和去乙酰化酶(HDACs)共同决定的。在细胞核内,组蛋白乙酰化与组蛋白去乙酰化过程处于动态平衡,精确地调控基因的转录和表达。
乙酰化修饰发生在蛋白质赖氨酸残基的侧链上,这种修饰作用不仅中和了赖氨酸残基侧链上的正电荷,增加了侧链的疏水性和体积,而且破坏了它形成氢键的能力。发生乙酰化修饰的蛋白质会改变其生化特性或构象,因此,当蛋白质受到可逆的乙酰化修饰时很可能会增加或丢失一部分功能, 或者改变它在细胞中的稳定性。蛋白质赖氨酸乙酰化是一种多功能信号调节方式,它的作用远远超出了调控基因转录和染色体重塑的范围。赖氨酸乙酰化作用的生化特点和普遍存在的特性,提示它可能与发育、衰老、疾病等生理和病理过程相关。
事实上,像PhosophoSitePlus等公共数据库显示,在人体细胞中有24000多个赖氨酸乙酰化位点,这意味着,这种翻译后修饰可能在信号传导网络方面有宽广的作用。细胞核和非核细胞腔隙频繁发生的修饰表明乙酰化在信号传导方面有重要的作用,然而,至今并没有乙酰化依赖的信号传导通道被报道。赖氨酸的乙酰化,通过对细胞内多种蛋白质的修饰调节,可以控制体内多种代谢过程,如调节糖类、脂类、氨基酸、核苷酸及次级代谢物的代谢等。因而,细胞内赖氨酸乙酰化失调,可影响与代谢相关的多种疾病,如肥胖症、糖尿病和心血管疾病等。随着对蛋白质乙酰化研究的深入,发现赖氨酸乙酰化与细胞免疫状态及神经退行性疾病,如阿尔茨海默氏症和亨廷顿综合征等也有关。乙酰化水平异常跟各种疾病相关,尤其是癌症的发展,反常的组蛋白乙酰化,经常促进致癌基因的表达,导致细胞的增殖和肿瘤的发生。
表观遗传学已经被定义为翻译后修饰模式的遗传转变,这会导致DNA序列中未被编码的新表型的发展。现在,普遍认为,这些复杂表观遗传编码的变化是导致某些疾病的主要机制之一。
组蛋白乙酰化的翻译后修饰是染色质的一个标志。松散的染色质结构可以被DNA和RNA聚合酶以及转录因子接近,从而激活基因的转录。乙酰转移酶(HATs)和组蛋白去乙酰化酶(HDACs)调控组蛋白的乙酰化水平。在疾病中,这些酶通常通过异常的表达水平,突变体的出现、截短基因及染色体重排等机理难以控制。
越来越多的研究表明,肿瘤是一种由代谢缺陷所产生的疾病。几乎所有调控细胞中间代谢的酶类和代谢相关蛋白都发生了赖氨酸乙酰化修饰,这表明赖氨酸的乙酰化修饰在肿瘤细胞代谢调控过程中起着非常重要的作用。研究还表明,这些发生赖氨酸乙酰化修饰的代谢酶均为HDAC抑制剂的作用靶点。从而提示,探索研究新型的HDAC 抑制剂类药物将有可能为临床肿瘤治疗提供新的切入点。在癌细胞中,HDAC的过度表达导致去乙酰化作用的增强,通过恢复组蛋白正电荷, 从而增加DNA与组蛋白之间的引力, 使松弛的核小体变得十分紧密, 不利于特定基因的表达, 包括一些肿瘤抑制基因。组蛋白去乙酰化酶抑制剂则可通过提高染色质特定区域组蛋白乙酰化,从而调控细胞凋亡及分化相关蛋白的表达和稳定性,诱导细胞凋亡及分化,成为一类新的抗肿瘤药物。HDAC抑制剂不仅对多种血液系统肿瘤和实体瘤具有良好的治疗作用,而且具有肿瘤细胞相对较高选择性和低毒的优点。目前在肿瘤研究领域,肿瘤代谢的研究及肿瘤表观遗传学的研究正方兴未艾,通过探索与肿瘤代谢缺陷相关的特异效应分子及HDAC 抑制剂类药物特异的代谢底物,将会为新药开发及肿瘤治疗带来新的机会。在癌症中,去乙酰化酶的失调导致生长促进基因转录的上调,肿瘤抑制基因的下调,同时还导致微核糖核酸活性的反常,这些发现成功地促进了去乙酰化酶抑制剂在肿瘤方面的临床应用。
尽管去乙酰化酶抑制剂成功的应用于癌症的治疗,对于中枢神经系统等疾病的应用也正在研究中,但批准上市的去乙酰化酶抑制剂并没有选择性。这些批准上市的抑制剂的多效性使得研究和了解分子作用机制很困难,因此阻碍了它们在临床方面更广泛的应用。特定的化学工具化合物,也称化学探针,它是靶向于表观遗传翻译后修饰,已经成为一个很好的方法来验证复杂的潜在机理的疾病治疗的新办法。溴结构域是多种不同蛋白质上发现的一些小的作用单元,其中一些蛋白质在转录调控因子配合物的乙酰化依赖组装中起关键作用。几种针对溴结构域的高选择性化学探针已经被发现,研究结果表明溴结构域抑制剂可能有一些潜在的临床应用。
1.2.2溴结构域蛋白简介
溴结构域蛋白:乙酰基的识别
赖氨酸残基ε-N乙酰化的识别起初是由溴结构域的研究开始的,溴结构域家族是一类进化上保守的蛋白质作用单元,早在二十世纪九十年代从果蝇的brahma基因发现的。人类蛋白组编码61种溴结构域,它们存在于46种不同的细胞核和细胞质蛋白质中。这些溴结构域包括乙酰转移酶和乙酰转移相关的蛋白质(例如GCN5L2,PCAF,BRD9),组蛋白甲基转移酶(例如ASH1L,MLL),解旋酶(例如SMARCAs),依赖ATP的染色质改构复合物(例如BAZ1B),转录辅激活因子(例如TRIMs和TAFs),转录介质(如TAF1),核支架蛋白(如PBRM1)以及BET蛋白家族。
溴结构域更广泛的生物功能在其他文献中有所综述。包含溴结构域的蛋白质参与转录程序的调节,并且在致癌基因重排中被发现,导致高度致癌的融合蛋白,这些融合蛋白在几种恶性肿瘤的发展中起关键作用。除此之外,溴结构域蛋白参与调控NF-κB ,NF-κB 是一个关键的调控炎症反应的转录因子,它们也与病毒基因组的复制、一些病毒蛋白质转录的调控有关。总之,以这些蛋白作为靶点是研发抗肿瘤,抗炎以及抗病毒药物的有效策略。
剩余内容已隐藏,请支付后下载全文,论文总字数:27792字
相关图片展示: