论文总字数:33303字
摘 要
地质聚合物(Geopolymer)这一概念最早在上个世纪70年代末首先由法国科学家Joseph Davidovits提出,现在人们一般把由硅氧四面体和铝氧四面体聚合而成的具有非晶态和准晶态特征的三维网络凝胶体统称为地质聚合物。
本文采用碱激发偏高岭土方法制备了地质聚合物,并对其进行了表面疏水功能化改性处理。采用水、氢氧化钠、水玻璃和偏高岭土,通过机械搅拌和固化的方式,制备了地质聚合物,在研究过程中发现其颗粒尺寸与制备条件相关,我们所发现的影响因素包括:所采用的粒径减小的方式(高速球磨或者高速搅拌)和是否对样品进行熟化处理。本文研究了高速球磨、高速搅拌和熟化对制备过程和最终地质聚合物产品粒径大小影响。
对地质聚合物小颗粒进行了表面疏水功能化改性处理,表面活性剂为西曲溴铵(CTAB),实验中研究了西曲溴铵用量对最终产品疏水性能的影响和西曲溴铵的添加时间对于产品制备工艺的影响。同时研究了在不同分散体系中改性地质聚合物颗粒的分散能力。
关键词:地质聚合物,表面功能化,纳米颗粒,CTAB
hydrophobic functionalization of geopolymer surface
Abstract
The concept of geopolymer was first proposed by French scientist Joseph Davidovits at 1970s. Now the term “geopolymer” usually refers to gel that is amorphous or quasi-crystal with 3 dimension network consists of alumina and silica tetrahedrons.
In this study, geopolymer small particles were synthesized by alkali activation, the particles were then modified. Geopolymer was synthesized with water, sodium hydroxide, sodium silicate solution and metakaolin, the ingredients were mixed by mechanical stirring and then geopolymer monolith was formed by curing. During this study, we discovered that the size of geopolymer particles is related to the synthetic method. The means of breaking up the particles (homogenization or high speed ball mill) and aging are two main factors that will affect the final size distribution of geopolymer. Therefore, in this study, we tested those factors effects on the size distribution of geopolymer product.
Modified geopolymer small particles with surfactant cetyltrimethylammonium bromide(CTAB), studied the effect of CTAB amount on the hydrophobicity of modified geopolymer, geopolymer’s ability to disperse in different organic solvents was then studied. At last, the effect of CTAB’s amount and adding time on the synthesize process were studied.
KEYWORDS: geopolymer, surface functionalization, nanoparticles, CTAB
目录
摘 要 II
Abstract III
第1章 绪论 1
1.1 硅酸盐和铝硅酸盐 1
1.2 沸石 1
1.3 沉淀铝硅酸盐 3
1.4 粘土 4
1.5 地质聚合物及其制备与应用 6
1.6 论文主要研究内容 9
第2章 实验方法 12
2.1 实验仪器与药品 12
2.2 实验内容 12
2.2.1 地质聚合物的制备 12
2.2.2 地质聚合物的清洗和中性化 12
2.2.3 地质聚合物的表面改性 13
2.2.4 系统性的研究不同制备因素对于地质聚合物不同性质的影响 13
2.3 材料的表征 13
第3章 结果与讨论 14
3.1 地质聚合物 14
3.2 表面改性的地质聚合物的研究 15
3.3 不同的CTAB含量以及熟化对未清洗的地质聚合物颗粒沉淀的影响 18
3.4 高速球磨、高速搅拌和熟化对于地质聚合物颗粒减小的影响 19
第4章 结论与展望 22
参考文献 23
致谢 27
绪论
硅酸盐和铝硅酸盐
氧和硅是地壳中含量最高的两种元素之一,正因为如此,地球上存在着大量的不同结构的硅氧基矿物,此外,还有大量合成的、具有不同结构的硅氧基化合物。不论是在矿物还是人工合成的化合物中,在常温常压下,硅原子在和氧原子结合时以都 4氧化态的形式存在,并倾向于占据配位数为4的四面体位置,因此,通常用SiO44-这一非常简单的形式来表示硅酸盐或者铝硅酸盐中的基本结构单元。四面体SiO44-单元有非常强的通过共用氧原子聚合,从而形成更大单元的硅酸盐矿物和化合物的趋势。在单独的SiO44-化合物(原硅酸盐)中,硅氧比Si:O为1:4,随着SiO44-单元聚合程度的提高,这一比例逐渐下降。在三维网络结构中,SiO44-完全聚合,硅氧比达到最低值1:2。这些三维网络结构既可以是晶体结构(广为人知的网状硅酸盐),也可以是无定型的非晶结构,其中一些结构除了硅之外也含有铝元素。
当额外的铝原子(地壳中含量第三高的元素)替代了硅酸盐结构中的一部分硅原子形成铝硅酸盐时,其结构的复杂度也大大增加了。由于铝的高度的正电性,以及其在与氧原子结合时仅存在 3氧化态,硅酸盐的四面体结构被打破,形成的铝硅酸盐在结构和组成上都呈现出非常吸引人的性质。铝原子每替代一个硅原子,都会带来电荷的不平衡,就需要有其他的阳离子,如钠离子Na 、钾离子K 、钙离子Ca2 等来补偿这一电荷的不平衡。除了配位数4,铝还存在于配位数为6的八面体位置,由此形成了非常有趣的结构。在这一些结构中,一个例子是粘土,其拥有层状结构,由铝原子与六个氧原子组成的结构单元组成,这些层状结构没有三维稳定性,并且可能会由于水或其他分子、离子的作用而导致层与层之间分离。
由共用氧原子的SiO4和AlO4四面体三维结构形成的铝硅酸盐结构,既有可能是晶体结构,也可能是无定型的非晶结构[1]。如果其结构是晶体,那么他们被称作框架结构,其中长石、方钠石和沸石是三大最常见的此类铝硅酸盐。反之,地质聚合物(通过碱激发的地质聚合反应生成的非晶型三维网状结构的铝硅酸盐)和沉淀硅酸盐被认为属于非晶类。
沸石
沸石是众多微孔结构材料中最重要的成员之一。习惯上,“沸石”这一术语通常指的是晶状铝硅酸盐或者氧化硅多晶,其是通过共角的TO4(T为铝或硅)四面体形成的三维网状结构,同时结构中含有形状大小一致的分子尺度的开孔和空洞[2]。今天,“沸石”这一词通常被用来形容四面体类型配位原子组成的共角的三维网状结构,其组成元素并不仅限于铝原子和硅原子,磷、钛、硼、镓、铍和锗等都可以存在其中。国际沸石协会承认的沸石结构目前总共有225种[3],通过如环状结构的大小、开放孔洞、电荷密度、结构密度(FD, 每1000Å3中T原子的密度)等因素来区分每一种沸石结构。
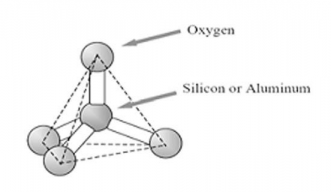
图1-1 沸石结构的基本组成单元:TiO4四面体(T=Si或Al)
从结构上来说,以T原子为中心的四面体结构是沸石的基本组成单元(图1-1),这些四面体彼此连接在一起形成特定的群组,这些群组被称为二次结构单元(图1-2)[4]。在二次结构单元中,硅原子和铝原子处在图中线条交叉的地方(T位置,图中黑点),氧原子在每条线的中间(图中红点)。
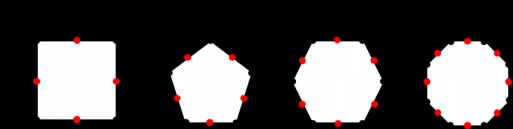
图1-2 一些二次结构单元:简单4环,S4R (a)、简单5环,S5R(b)、简单6环,6R(c)和简单8环,8R(d)。由Meirer和Smith提出[5]。
这些二次结构单元又进一步连接在一起形成更大的“笼子型”结构,这一笼形结构称为笼形结构单元或复合组成单元(图1-3)。通过对这些复合组成单元进行分类,我们可以区分不同的框架结构。这些复合组成单元又进一步连接在一起形成沸石的总体框架结构,同样的复合组成单元可以通过不同的连接形成不同的结构类型,SOD笼形结构可以通过(1)共享4环结构形成SOD(方钠石)结构、(2)加倍4环结构形成LTA(林德A型)结构以及(3)加倍6环形成FAU(八面沸石型)以及EMT结构[6],即八面沸石有着FAU的FAU框架结构。
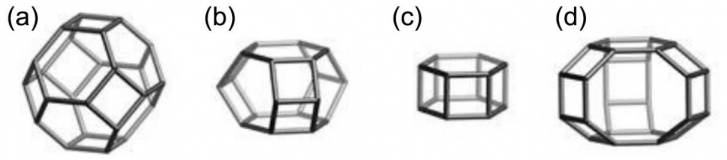
图1-3 一些沸石笼形结构单元:SOD(a)、CAN(B) 、D6R(c)和GME(d)笼形。
笼型结构连接形成框架结构,形成了在整个结构中存在的孔洞。孔洞的大小被定义为最小的外接球的大小,这些环状结构通常是8元或者10元环。当定义环形结构或者孔洞大小的结构时,仅仅将T位置计入考虑范围之内。孔的形态取决于具体的框架结构,所形成的孔洞可能是一维、二维或者三维的(图1-4)。如果结构框架中有多于一种的孔洞结构,那么这些孔洞可能是相互连接的,也可能是彼此之间完全分离的(图1-5)。
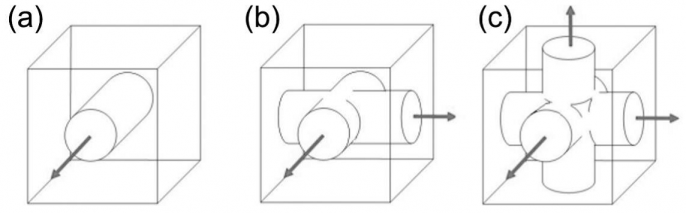
图1-4 相互连接的孔洞:一维(a)、二维(b)和三维(c)[7]。
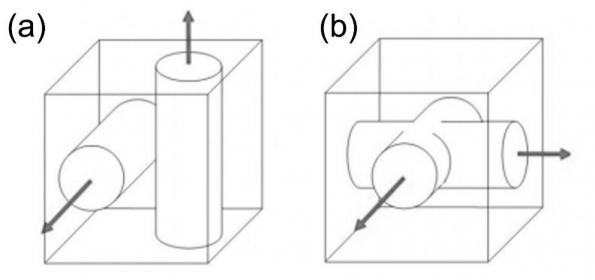
图1-5 独立的彼此之间不连接的孔洞系统(a)和相互连接的孔洞系统(b)[7]。
铝硅酸盐沸石可以通过以下的经验组成式来表示:
在这一组成式中,通常大于等于2,其是由罗温斯坦法则决定的[8],罗温斯坦法则指出:在这一结构中,没有两个AlO4四面体可以彼此相邻。这意味着每一个AlO4四面体都必须被四个SiO4四面体环绕着;n为阳离子空位数。最好的表达沸石的结构的表达式可以用晶体学上单位晶胞的组成来表达:
M为价态为n的阳离子,w是水分子的数目。取决于不同的沸石结构,y/x这一比例大于或者等于1。为在一个单位晶胞中四面体结构的总数[9]。
沸石可以在自然界中找到,也可以在实验室中合成。天然沸石在1756年第一次被瑞典矿物学家Cronstedt[10]发现,但是这些沸石的多微孔性质和在离子交换中的应用,直到19世纪才逐步被发现。到2007年,超过40种的天然沸石被发现,它们广泛地被应用到气体和液体的干燥和分离、硬水的软化、污水处理以及土壤改善上来。虽然天然沸石缺乏催化剂应用所需要的纯度,但是一些优选和改性的沸石在工业上已经被用作催化剂或者催化剂的载体[11]。
早期,地质学家和矿物学家主导着沸石的合成,他们通过模拟自然过程(地热条件)的方法来合成沸石,这些模拟的地热条件包括高温(约200℃)和相应的与水热条件相关的升压。这些尝试持续了十几年,但并没有取得真正的成功。在19世纪30年代末期,工业上产生了大量的对于沸石的需求,这直接引起了大量关于合成沸石的研究。对于沸石的需求一部分来源于它们新发现的催化性能:这些新型的催化剂有着所有优秀的催化剂所需要的性质:反应活性、稳定性、选择性、恰当的孔洞大小、抗污性和低价[12]。
第一种合成沸石为A型沸石(LTA),其铝硅比为1,由Union Carbide公司于1949年生产。这种沸石有非高的离子交换能力,但是不会转换成酸的形式,在FCC(催化裂化技术)科技所需要的条件下非常稳定。X型沸石拥有八面沸石结构,铝硅比1: 2,在1950年以Na-形式被制备出来,它没有酸性催化剂催化活性。为了得到酸性催化活性,将X型沸石与稀土金属,主要是镧和铈进行离子交换[12]。
在温和的水热条件而不是地热条件下(约100℃,常压)制备出来的沸石,是一类非常重要的商业合成沸石。许多美国公司,如Linde、UCC、Mobil以及Exxon都投入了大量的研究。1954年到19世纪80年代早期是合成沸石发展的黄金时期。在1954年底,工业上开始大量生产A型沸石和X型沸石[12]。
剩余内容已隐藏,请支付后下载全文,论文总字数:33303字
相关图片展示:



该课题毕业论文、开题报告、外文翻译、程序设计、图纸设计等资料可联系客服协助查找;


