论文总字数:15915字
目 录
1.引言 4
2.实验部分 4
2.1实验材料与设备 4
2.2实验准备工作 5
2.3实验方法 5
2.4分析方法 6
2.4.1pH值的测定 6
2.4.2磷浓度的测定 6
2.4.3钙元素浓度的测定 6
3.结果与讨论 7
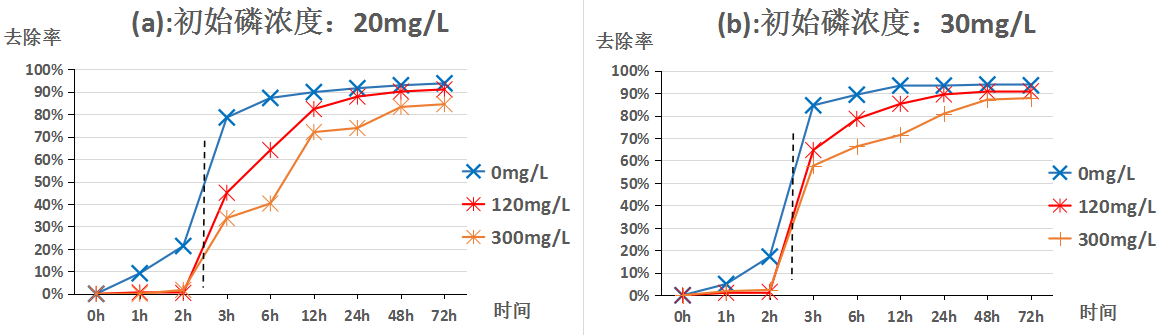
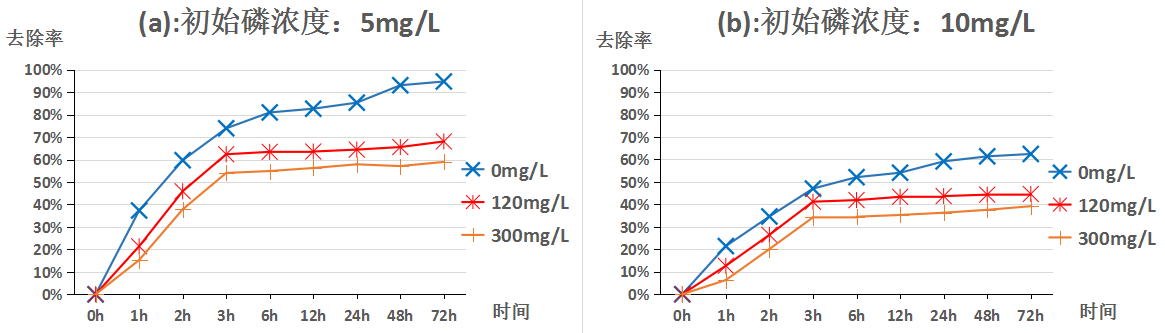
3.1pH值为7.7时苹果酸浓度变化对方解石去除不同浓度磷的影响 7
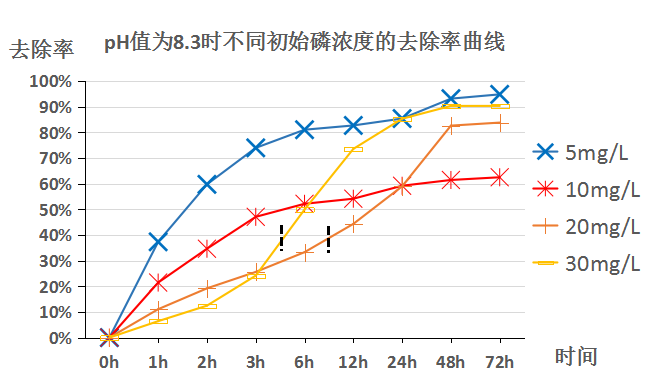
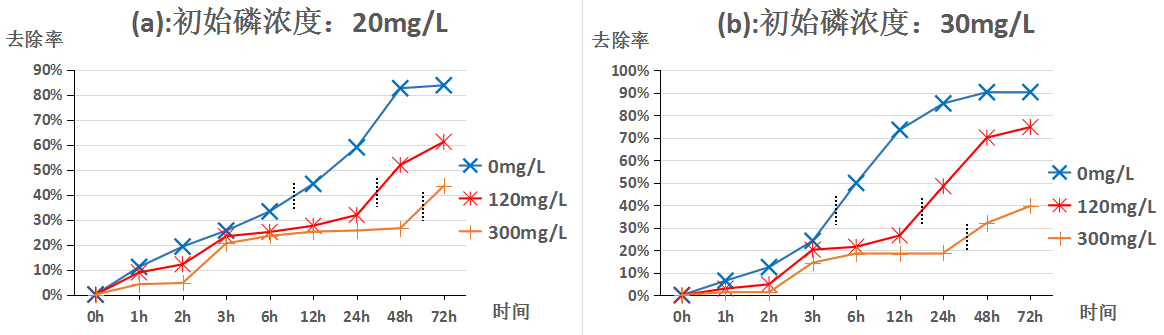
3.2pH值为8.3时苹果酸浓度变化对方解石去除不同浓度磷的影响 10
4.结论 12
参考文献 13
致谢 14
苹果酸对方解石除磷影响的研究
王知
,China
Abstract: The effect of malic acid on the removal of phosphorus from calcite was studied by batch balance method in the open system with malic acid in equilibrium. The results showed that: 1) the presence of malic acid in the system inhibited the removal of phosphorus from calcite, and the higher the initial concentration of malic acid, the more obvious the inhibitory effect. 2) The study of kinetics shows that: 1) the presence of malic acid in the system shortens the equilibrium time required to adsorb phosphorus on the surface of calcite and reduces the phosphorus removal rate after equilibration. 2) The presence of malic acid in the system will prolong the reaction time of calcium and phosphorus precipitation, reduce the reaction amount of calcium and phosphorus precipitation, reduce the removal rate of calcite by phosphorus and phosphorus precipitation reaction, and postpone the final equilibrium time point. The presence of malic acid will delay the onset of calcium phosphate precipitation reaction, but when the calcium ion concentration is high, will not produce this effect.
Key words: malic acid; calcite; phosphorus; adsorption; kinetics
1.引言
众所周知,磷是水体中的主要污染物之一[1],过量的磷是引起水体富营养化的罪魁祸首[2],在化工行业飞速发展的时代,高效、绿色地除磷是极其有价值的话题。近年来,通过方解石去除磷的新型方法因其高效性、低成本及可再利用性而被国内外学者广泛的研究。已有学者研究发现邻苯二甲酸在不同的磷浓度条件下能对方解石除磷起到促进和抑制两种截然相反的影响[3]。苹果酸是自然界中常见的有机酸,也是废水中存在的一种有机物,它与邻苯二甲酸同为有机二羟酸,同样能被方解石吸附。因此,研究苹果酸对方解石除磷的影响具有一定的价值。
方解石是自然界中最多的矿物之一,它是一种碳酸钙矿物。使用方解石作为吸附剂还有以下优点①方解石粉末价格十分低廉,与其他常见的水体除磷法相比,使用方解石吸附会使除磷成本大大降低。②方解石无毒无害、易回收且对水体不会产生额外的影响。且已有研究表明方解石除磷后的产物并不是纯粹的废弃物,它可以被用来去除水中的磷酸盐或直接成为酸性土壤的肥料[4-5]。③方解石比表面积大,对磷酸盐的固定能力十分强,是优秀的天然吸附剂。当单位质量的方解石吸附了足够多的磷酸盐后,它作为磷的载体,也是一种非常可靠的磷提取原料。
在方解石的除磷机理上,根据前期学者们的研究[6-11],可以简单概括为以下两种:①表面吸附。方解石比表面积大,表面吸附点多,能吸附水体中的磷酸根离子。②沉淀去除。当磷浓度较高时,磷离子与方解石溶出的钙离子形成钙磷沉淀,通过沉淀的形式将磷去除。
学者们[12-13]在研究方解石除磷机理时总结出了这样的规律:在磷浓度较低的条件下,磷的去除主要是依靠其在方解石表面吸附;在磷浓度较高的条件下,表面吸附不再占据除磷的主导地位,而是转变为与钙反应形成钙磷化合物沉淀的方式从液体中被除去。此外,同样的初始磷浓度,pH值的不同也会使方解石除磷的规律发生变化。
通过赵雪松[14]、盛夏[15]、徐虹[16]、印红伟[17]等人的研究表明对于方解石除磷的影响因素众多,主要有方解石粒径及比表面积、温度、初始磷浓度、体系pH值、吸附时间、体系中的其他离子等。本文所涉及实验均在同样温度下(25℃)采用同种方解石,研究不同pH值、不同初始磷浓度、不同吸附时间、不同初始苹果酸浓度对方解石去除磷的规律。
2.实验部分
2.1实验材料与设备
采用粒径约为700nm,比表面积约为20m2/g的方解石(分析纯)、L-苹果酸(分析纯,下文提到的苹果酸均为L-苹果酸)、磷酸二氢钾(分析纯)进行实验。此外,还用到了四水合钼酸铵(分析纯)、浓硫酸(分析纯)、抗坏血酸(分析纯)和酒石酸锑钾(化学纯)
恒温振荡器(THZ-C,太仓市强乐实验设备有限公司)、电子分析天平(FA2004,上海上天精密仪器有限公司)、pH计(PHSJ-4F,上海仪电科学仪器有限公司)、低速自动平衡离心机(TDZ5-WS,湖南湘仪实验室仪器开发有限公司)、紫外可见分光光度计(CARY-50,上海菁华科技仪器有限公司)、原子吸收分光光度计(3150G,安捷伦上海分析)
2.2实验准备工作
本次实验实验环境均为25℃室温,恒温振荡器设置温度也为25℃。
本次实验设置两组pH值(pH7.7和pH8.3),每组pH值都设置四组初始磷浓度(5mg/L、10mg/L、20mg/L和30mg/L),两组pH值中的每组初始磷浓度又设置三种不同的初始L-苹果酸浓度(0mg/L、120mg/L、300mg/L),选择1h、2h、3h、6h、12h、24h、48h、72h八个时间点,并设置平行对比样,共计384个单独的体系。
空气中的二氧化碳会溶解至水中,其中一小部分会与水发生可逆反应生成碳酸而改变水体pH值。此外,碳酸钙稍溶于水,且在不同的pH条件下溶解度不同。为了控制pH值及等量每个体系中的方解石固体质量,本实验用水采用pH值7.7及8.3的碳酸钙平衡水,其制备方法如下:使用天平称取两组5g方解石分别加入预先准备好的两个盛有5L去离子水的开口容器中并搅拌均匀,在其中一个开口容器中加入38g 2mol/L的HCl溶液。将两个开口容器放入恒温振荡器(THZ-C)中震荡足够长的时间后分别测得pH值为7.7及8.3,此时对两组开口容器中的溶液分别进行抽滤并将滤液分别密封保存,即得pH值为7.7及8.3的碳酸钙平衡水。
每个离心管为一个单独的体系。在每个离心管中加入0.1g方解石及40mL所需pH值的碳酸钙平衡水,密封后放入恒温振荡器(THZ-C)以备使用。
制作以P计10000mg/L的磷酸二氢钾母液:使用电子分析天平(FA2004)准确称取4.3871g磷酸二氢钾(分析纯)溶解于烧杯中,在100mL容量瓶中定容,调节pH至中性。
制作以C计60000mg/L的L-苹果酸母液:使用电子分析天平(FA2004)准确称取8.3750g L-苹果酸(分析纯)溶解于烧杯中,在50mL容量瓶中定容,调节pH值至8左右。
2.3实验方法
对于初始苹果酸浓度为120mg/L的体系,用移液枪移取80μL苹果酸母液加入其中。对于初始苹果酸浓度为300mg/L的体系,用移液枪移取200μL苹果酸母液加入其中。对于初始苹果酸浓度为0mg/L的体系,不作任何处理。完成后将所有体系均放入恒温振荡器(160r/min)中振荡48h以上。取出后测定每个体系的pH值(PHSJ-4F型pH计,上海仪电科学仪器有限公司)。
苹果酸预平衡完成之后,向每个体系中加入相应量的磷酸二氢钾母液来达到设计的初始磷浓度:磷初始浓度为5mg/L的体系中加入20μL的磷酸二氢钾母液;磷初始浓度为10mg/L的体系中加入40μL的磷酸二氢钾母液;磷初始浓度为20mg/L的体系中加入80μL的磷酸二氢钾母液;磷初始浓度为30mg/L的体系中加入120μL的磷酸二氢钾母液。
全部加入完毕后,将所有体系放入恒温振荡器(160r/min)中,并开始计时。到达相应时间点(1h、2h、3h、6h、12h、24h、48h、72h)时,将所有对应时间点的体系取出后使用低速自动平衡离心机(TDZ5-WS,湖南湘仪实验室仪器开发有限公司)离心,分别取出上清液后分别存放,测量并记录pH值。
2.4分析方法
2.4.1pH值的测定
在25℃室温下使用pH计(PHSJ-4F,上海仪电科学仪器有限公司)对体系的pH值进行测量。根据该pH计使用说明,在使用前进行三点标定进行校准。每次测定完成后使用蒸馏水冲洗玻璃电极,拭干水分后进行下一次测定。
2.4.2磷浓度的测定
本实验需要测定磷酸根的含量,选用磷钼蓝比色法。本实验中溶液的磷初始浓度均超过了磷钼蓝比色法所能测定的磷浓度范围。故在使用本法测定前,需将待测溶液稀释合适的倍数来满足磷钼蓝比色法的要求(初始磷浓度5mg/L的体系的待测溶液均稀释五倍,初始磷浓度10mg/L的体系的待测溶液均稀释十倍,初始磷浓度20mg/L的体系的待测溶液均稀释二十倍,初始磷浓度30mg/L的体系的待测溶液均稀释三十倍。)
此法中钼锑抗作为比色液需现配现用,故首先配制可短期储存的钼锑抗储备液,其配制方法如下:取大烧杯加入1L蒸馏水、153mL浓硫酸(H2SO4,分析纯,上海凌峰化学试剂有限公司)、10g四水合钼酸铵((NH4)6Mo7O24·4H2O,分析纯,国药集团化学试剂有限公司)和0.5g酒石酸锑钾(KSbC4H4O7·1/2H2O,化学纯,国药集团化学试剂有限公司),长时间搅拌溶解后避光保存。
剩余内容已隐藏,请支付后下载全文,论文总字数:15915字
相关图片展示:
该课题毕业论文、开题报告、外文翻译、程序设计、图纸设计等资料可联系客服协助查找;


