论文总字数:14268字
目 录
1引言 1
1.1 研究背景 1
1.2 国内外研究现状 1
1.3 本课题研究目的及内容 1
2 实验材料与方法 1
2.1 实验材料 1
2.1.1 实验试剂 1
2.1.2 平衡水的配制 2
2.1.3 丙二酸溶液的配制 2
2.1.4 磷母液的配制 2
2.1.5 钼锑抗储备液配制 2
2.1.5 实验仪器 2
2.2 实验方法 2
2.2.1 ph=7.7的丙二酸对磷在方解石上的吸附影响实验 2
2.2.2 Ph=8.3的丙二酸对磷在方解石上的吸附影响实验 3
2.2.3 Ph=8.7的丙二酸对磷在方解石上的吸附影响实验 3
2.3 分析方法 3
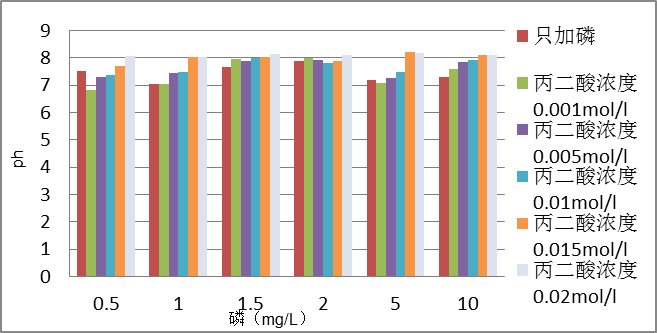
2.3.1 ph值的测定 3
2.3.2 溶液中磷浓度的测定 3
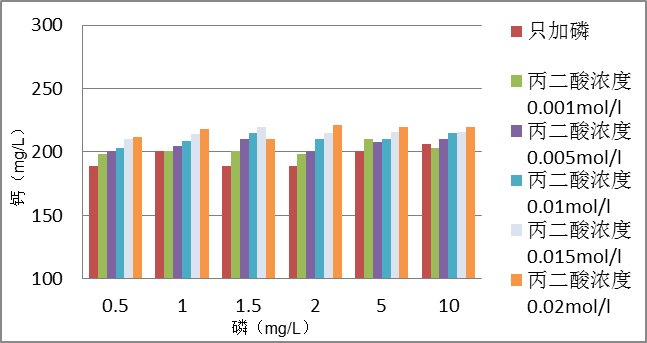
2.3.3 钙浓度的测定 3
3 结果与讨论 4
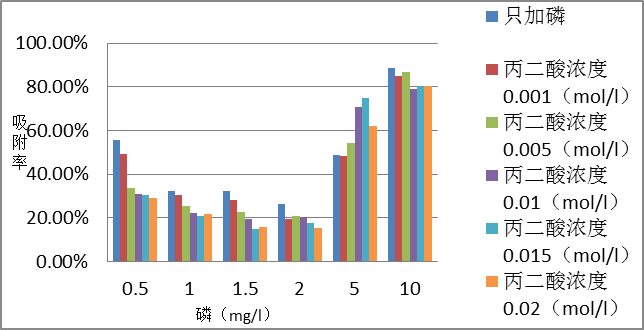
3.1 PH=7.7的丙二酸对磷在方解石上的吸附影响 4
3.1.1 反应6h的影响 4
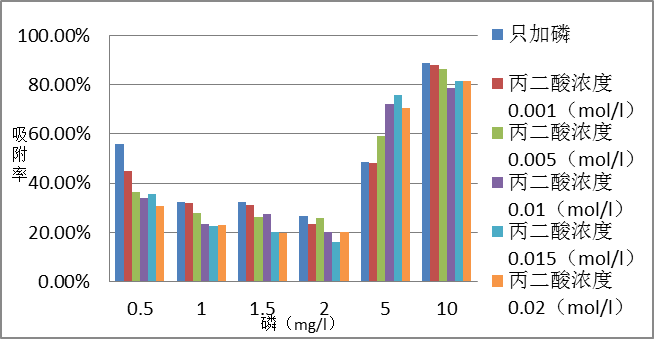
3.1.2 反应24h的影响 6
3.2 ph=8.3的丙二酸对磷在方解石上的吸附影响 7
3.2.1 反应6h的影响 7
3.2.2 反应24h的影响 9
3.3 ph=8.7的丙二酸对磷在方解石上的吸附影响 10
3.3.1 反应6h的影响 10
3.3.2 反应24h的影响 12
3.4 不同ph的影响 13
4 结论 13
参考文献 13
致 谢 15
丙二酸对磷在方解石上吸附的影响
覃灵川
,China
Abstract: In this paper, the effect of the adsorption of phosphorus on calcite by experiments was studied. The results showed that the adsorption of phosphate on calcite was inhibited by C. In the low phosphorus concentration, phosphorus removal is mainly for the adsorption of phosphate on the calcite surface, and the adsorption site of the calcite on the competition with phosphoric acid, resulting in inhibition of phosphorus adsorption. In high phosphorus concentrations, the inhibitory effect of different pH environment is different, mainly due to the effects of calcium ion concentration in the solution and in the ph=7.7. At higher calcium concentration, competition of malonic acid and phosphate on the overall removal rate to reduce the impact, in ph=8.3, calcium concentration, competition of malonic acid and phosphoric acid on the overall removal rate has great influence; very little calcium ions in the ph=8.7, and malonic acid added on the overall not too big effect; while adding malonic acid and phosphorus and has joined the phosphorus removal had no much difference; the length of the reaction time difference is also reflected in high phosphorus concentration. The main or phosphorus removal mechanism of the different effects.
Key words: Calcite; potassium dihydrogen phosphate; malonic acid
1 引言
1.1 研究背景
随着社会的发展,生活污水和工业废水的排放对环境造成了严重的污染。其中磷污染的情况尤其严重,现代农业和磷化工工业加速了磷的溶解速度,使水体中磷的浓度不断提高,造成了水体富营养化[1],水治理和防治磷污染已刻不容缓。作为天然矿物之一的方解石具有比表面积大、价格低廉易获取等特点,已有研究表明采用方解石可有效去除和回收水中的磷酸盐[2-6]。同时方解石对丙二酸也有一定吸附作用,因此,探究丙二酸对磷在方解石上的吸附影响具有一定现实意义。
1.2 国内外研究现状
许多学者都对磷在方解石上的吸附机制进行了广泛研究,得出了比较统一的意见[7,8]:在磷低浓度时,主要是通过表面吸附的方式进行磷的去除,在磷高浓度时,主要是通过形成钙磷化合物沉淀的形式去除。
现实中的水体比较复杂,温度、Ph环境的不同和许多复杂的成分,如Mg2 ,So42-,草酸,丙二酸等,这些因素总会对磷的去除率造成一定的影响。闫志为、钱会等人[9-11]的研究表明,碳酸钙的溶解会受到很多因素的影响,如温度、二氧化碳等。赵雪松等人[12]的研究结果表明ph值对方解石的溶解有相当大的影响,ph=6时,促进方解石溶解,Ca2 浓度增加,去除率变大,并且高于ph=7和ph=9时的去除率。Snoeyink V L[13]等的研究结果表明,在碱性条件下,Mg2 的存在对方解石对磷酸盐的吸附有一定促进影响。何振立[14]等人研究发现,当溶液中硫酸根离子和有机阴离子同时存在时,会形成一定竞争吸附,使得磷的去除率下降。闫志为与Liu Y等人[15,16]的研究推测了SO42-离子对方解石去除磷的影响机机理为SO42-离子会提高方解石的溶解度,印红伟[17]等的研究也验证了闫志为等人的推测,当ph=6.0时,SO42-会抑制磷在方解石上的吸附作用。丙二酸作为自然界中植物分泌物之一[18],十分常见,李振炫[19]等人的研究结果表明丙二酸在方解石上的吸附特性为先快后慢,并且ph升高,吸附率下降。Mann 等[20]的研究表明,丙二酸会与方解石表面吸附点位产生络合效应,从而对其的生长形态产生一定影响。
1.3 本课题研究目的及内容
本文将在常温背景下,对丙二酸对磷在方解石上的吸附影响进行研究。
研究将围绕以下几个几点进行。
(1)分别在不同ph环境下进行实验
(2)分别加入不同浓度试剂
(3)反应时间不同
(4)试剂加入顺序不同
这对进一步了解磷在方解石上吸附机制和为其他有机酸对磷在方解石上的吸附提供理论支撑。
2 实验材料与方法
2.1 实验材料
2.1.1 实验试剂
实验所用化学药品如表2-1所示。
表2-1 实验化学药品
试剂名称 | 型号与纯度 | 厂家 |
碳酸钙 磷酸二氢钾 抗坏血酸 丙二酸 | 分析纯 分析纯 分析纯 分析纯 | 西陇化工股份有限公司 国药集团化学试剂有限公司 国药集团化学试剂有限公司 国药集团化学试剂有限公司 |
2.1.2 平衡水的配制
Ph=7.7的平衡水配制:用电子天平称取4g方解石,加入4L去离子水,再加38ml 2mol/L 氯化氢溶液,放入恒温振荡器中进行震荡(25°C,160r/min)达到系统的预平衡(ph=7.7)取出。
Ph=8.3的平衡水配制:用电子天平称取4g方解石,加入4L水,放入恒温振荡器中进行震荡(25°C,160r/min)达到系统的预平衡(ph=8.3)取出。
Ph=8.7的平衡水配制:用电子天平称取4g方解石,加入4L去离子水,再加3.2ml 5mol/L氢氧化钠溶液,曝气至系统的预平衡(ph=8.7)取出。
2.1.3 丙二酸溶液的配制
用电子天平称取三份82.2389g丙二酸二钠,溶解,用500ml容量瓶定容,配制成以碳计40000mg/L的丙二酸溶液,并用不同浓度的氢氧化钠和氯化氢溶液调节ph值分别为7.7、8.3、8.7。
2.1.4 磷母液的配制
用电子天平称取0.21935g磷酸二氢钾,溶解,然后用500ml容量瓶中定容,配制成100mg/L的磷溶液。同样的,称取2.1935g磷酸二氢钾,溶解,定容到500ml容量瓶,配制成1000mg/L的磷溶液。
2.1.5 钼锑抗储备液配制
向1L水中加入153ml浓硫酸、10g钼酸铵、0.5g酒石酸锑钾,过夜溶解,避光储存。
2.1.5 实验仪器
实验所需仪器型号及厂家见表2-2。此外用到的仪器还有:烧杯、移液枪、容量瓶等。 表2-2 实验仪器
仪器名称 | 型号 | 生产厂家 |
紫外可见分光光度计 原子吸收分光光度计 剩余内容已隐藏,请支付后下载全文,论文总字数:14268字 相关图片展示:
您需要先支付 80元 才能查看全部内容!立即支付
该课题毕业论文、开题报告、外文翻译、程序设计、图纸设计等资料可联系客服协助查找; |